欢迎来到CC规范网,争做您的第一个学习站!
中华人民共和国国家标准
过氧化氢气体等离子体低温灭菌器卫生要求
Hygienic requirements for low-temperature hydrogen peroxide gas plasma sterilizer
GB 27955-2020
发布日期:2020-04-09
实施日期:2020-11-01
发布部门:国家市场监督管理总局、国家标准化管理委员会
前言
本标准的全部技术内容为强制性。
本标准按照GB/T 1.1-2009给出的规则起草。
本标准代替GB 27955-2011《过氧化氢气体等离子体低温灭菌装置的通用要求》。本标准与GB 27955-2011相比,主要技术变化如下:
——修改了标准的适用范围(见第1章,2011年版的第1章);
——修改了规范性引用文件(见第2章,2011年版的第2章);
——修改了术语和定义(见第3章,2011年版的第3章);
——删除了命名(见2011年版的第4章);
——增加了灭菌程序、过氧化氢灭菌剂、显示装置、记录与输出装置(见4.1、4.2、4.3、4.4);
——修改了灭菌效果评价及监测(见4.5,2011年版的5.1.2);
——修改了安全性的要求(见4.6,2011年版的5.2);
——增加了检验范围(见5.1);
——修改了安全性的检验方法(见4.6,2011年版的5.2);
——修改了使用注意事项(见第6章,2011年版的第8章);
——增加了过氧化氢气体等离子体低温灭菌的生物监测方法(见附录B)。
本标准由中华人民共和国国家卫生健康委员会提出并归口。
本标准起草单位:中国疾病预防控制中心环境与健康相关产品安全所、北京协和医院、北京大学口腔医院、河北省卫健委综合监督执法服务中心、山东省卫生健康委员会执法监察局、湖北省人民医院、青岛大学附属医院、山东省立医院、江西省卫生监督所、浙江省疾病预防控制中心、浙江大学医学院附属邵逸夫医院。
本标准主要起草人:张流波、张剑、张青、李炎、刘翠梅、王海森、袁青春、徐亚青、吕亚青、高辉、周玉、胡国庆、王亚娟、张海军、李亚东、邹辰明、刘霞、王娟、吴伟。
本标准所代替标准的历次版本发布情况为:
——GB 27955-2011。
1 范围
本标准规定了过氧化氢气体等离子体低温灭菌器的技术要求、应用范围、使用注意事项、检验规则、检验方法、标志与包装、运输和贮存。
本标准适用于不耐湿、不耐高温的医疗器械、器具和物品灭菌的过氧化氢气体等离子体低温灭菌器。
2 规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 191 包装储运图示标志
GB/T 1616 工业过氧化氢
GB/T 16886.5 医疗器械生物学评价 第5部分:体外细胞毒性试验
GB/T 16886.10 医疗器械生物学评价 第10部分:刺激与皮肤致敏试验
GB/T 16886.11 医疗器械生物学评价 第11部分:全身毒性试验
GB 19192-2003 隐形眼镜护理液卫生要求
GBZ 159 工作场所空气中有害物质监测的采样规范
GBZ/T 300.48 工作场所空气有毒物质测定 第48部分:臭氧和过氧化氢
消毒技术规范(2002年版) [卫生部(卫法监发〔2002〕282号)]
3 术语和定义
下列术语和定义适用于本文件。
3.1 等离子体 plasma
由离子、电子和中性分子或原子组成的混合体。
注:本标准的等离子体是由气体分子在电场作用下电离后形成的。
3.2 过氧化氢气体等离子体低温灭菌器 low-temperature hydrogen peroxide gas plasma sterilizer
在60℃下,用过氧化氢气体进行灭菌,并用等离子分解残留过氧化氢的装置。
3.3 准备期 conditioning stage
过氧化氢注入舱体前为准备灭菌进行真空和加热的过程,可有过氧化氢提纯、等离子体化过程。
3.4 灭菌期 sterilization stage
过氧化氢注入舱体,依靠过氧化氢气体在一定浓度、温度、压力下作用一定时间进行灭菌的过程。
3.5 解析期 ventilation stage
排出和分解过氧化氢气体的过程,包括真空排气、等离子体化过程。
4 技术要求
4.1 灭菌程序
4.1.1 概述
4.1.1.1 灭菌器应根据灭菌对象设置相应的灭菌程序,至少具有对医疗器械的表面、管腔和软式内镜的灭菌程序。
4.1.1.2 灭菌程序包括准备期、灭菌期和解析期三个阶段,可重复交叉。
4.1.2 准备期
4.1.2.1 灭菌舱压力下限应不高于制造商规定的压力,且应不大于80Pa。
4.1.2.2 灭菌舱内壁温度在准备期结束时应不小于45℃。
4.1.2.3 若发生等离子体,维持时间和输入功率应符合制造商的规定,维持时间实测值应不小于制造商规定的最低值,输入功率实测误差应在±10%范围内。
4.1.2.4 若有提纯,提纯后过氧化氢浓度和剂量应符合制造商的规定,误差应在±5%范围内。
4.1.2.5 灭菌物品过湿时应报警。
4.1.3 灭菌期
4.1.3.1 灭菌舱内壁温度应不大于60℃;设备设定最低温度的灭菌效果应经过验证。
4.1.3.2 灭菌期维持时间应符合制造商的规定,维持时间实测值应不小于制造商规定的最低值。
4.1.3.3 灭菌压力范围应符合制造商的规定。
4.1.3.4 灭菌期过氧化氢浓度范围应符合制造商的规定。
4.1.3.5 宜对灭菌舱内过氧化氢浓度进行实时监测。
4.1.4 解析期
4.1.4.1 灭菌舱压力下限应不高于制造商规定的压力,且应不大于80Pa。
4.1.4.2 发生等离子体,维持时间和输入功率应符合制造商的规定,维持时间实测值应不小于制造商规定的最低值,输入功率实测误差应在±10%范围内。
4.1.4.3 解析期结束后,灭菌负载的过氧化氢残留值应不超过30mg/kg·H2O。
4.2 过氧化氢灭菌剂
4.2.1 过氧化氢灭菌剂应符合GB/T 1616中60%过氧化氢的质量要求;有效期内过氧化氢浓度为53%~60%。
4.2.2 灭菌器应使用制造商配套的过氧化氢,使用中的有效期不小于10d,使用浓度应在53%~60%范围内。
4.3 显示装置
4.3.1 灭菌器应显示下列指标:
a)灭菌舱壁、门的温度。
b)灭菌舱压力。
c)等离子体输入功率。
d)灭菌程序各阶段名称和运行时间。
e)运行报警及代码。
4.3.2 灭菌期宜显示灭菌舱内过氧化氢浓度。
4.4 记录与输出装置
4.4.1 灭菌器应实时导出和记录下列指标:
a)灭菌舱壁、门的温度;
b)灭菌舱压力;
c)等离子体输入功率;
d)灭菌程序各阶段名称和运行时间;
e)运行报警代码。
4.4.2 灭菌器宜实时导出和记录灭菌舱内过氧化氢浓度。
4.5 灭菌效果评价及监测
半周期满载运行,无菌生长。
4.6 安全性
4.6.1 环境暴露
4.6.1.1 灭菌器应设置过氧化氢分解(过滤)器,并具有报警提示更换功能,制造商应在使用说明书规定其更换周期。
4.6.1.2 在满足灭菌器使用说明书中使用环境通风条件的工作场所,过氧化氢残留量应符合8h时间加权允许浓度(TWA)≤1.5mg/m3。
4.6.2 生物相容性
灭菌后物品应与人体生物相容。
4.6.3 材料相容性
对金属及非金属材料器械灭菌后进行兼容性评价,结果应为基本无腐蚀,评价结果只限用于经过测试的材质。灭菌后的材料外观不应有明显变化,如颜色、形状和裂痕等。
5 应用范围
5.1 过氧化氢气体等离子体低温灭菌器适用于不耐湿、不耐高温的医疗器械、器具和物品。
5.2 灭菌器不得用于以下对象的灭菌:
a)不完全干燥的物品;
b)吸收液体的物品或材料;
c)由含纤维素的材料制成的物品或其他任何含有木质纸浆的物品;
d)一头闭塞的内腔;
e)液体或粉末;
f)一次性使用物品;
g)植入物;
h)不能承受真空的器械;
i)标示为仅使用压力蒸汽灭菌法的器械;
j)器械具有内部部件,难以清洁的。
6 使用注意事项
6.1 在装载入灭菌设备前,灭菌物品应进行有效、正确的清洗和干燥处理。
6.2 包装材料应采用专用包装袋或医用无纺布。
6.3 灭菌物品的装载应严格按照灭菌器说明书要求进行,避免因装载不正确影响灭菌效果。
6.4 高浓度的过氧化氢会灼伤皮肤,正确操作灭菌设备同时采取个人防护措施。
6.5 使用灭菌剂过氧化氢的浓度及剂量与灭菌器说明书规定的要求一致。
6.6 应严格按照灭菌器说明书要求进行设备保养和维护。
7 检验规则
7.1 型式检验
型式检验包括:4.1.2,4.1.3,4.1.4,4.2,4.5,4.6。
7.2 出厂检验
出厂检验包括:4.1,4.2,4.3,4.4,4.5。
8 检验方法
8.1 灭菌程序检验
8.1.1 总体要求
按照制造商提供的使用说明书运行灭菌器,判断是否符合4.1.1.1和4.1.1.2。
8.1.2 准备期检验
8.1.2.1 将压力测量装置与灭菌舱的压力测试端口连结,运行灭菌周期,判断是否符合4.1.2.1。
8.1.2.2 用温度传感器测量灭菌舱内壁,运行灭菌周期,判断是否符合4.1.2.2。
8.1.2.3 使用秒表计量等离子体发生阶段时间,专用功率计计量等离子体发生器运行功率,运行灭菌周期,判断是否符合4.1.2.3。
8.1.2.4 运行灭菌周期,提纯阶段结束后,停止运行装置,拆开提纯装置,提取过氧化氢溶液,按照《消毒技术规范》(2002年版)的方法测量浓度,判断是否符合4.1.2.4。
8.1.3 灭菌期检验
8.1.3.1 用温度传感器测量灭菌舱内壁,运行灭菌周期,判断是否符合4.1.3.1。
8.1.3.2 运行灭菌周期,使用秒表计量灭菌期时间,判断是否符合4.1.3.2。
8.1.3.3 将压力测量装置与灭菌舱的压力测试端口连结,运行灭菌周期,判断是否符合4.1.3.3。
8.1.3.4 过氧化氢浓度传感器应定期校验,判断是否符合4.1.3.4。
8.1.4 解析期检验
8.1.4.1 将压力测量装置与灭菌舱的压力测试端口连结,运行灭菌周期,判断是否符合4.1.4.1。
8.1.4.2 运行灭菌周期,使用秒表计量等离子体发生阶段时间,使用专用功率计计量等离子体发生器运行功率,判断是否符合4.1.4.2。
8.1.4.3 运行灭菌周期,灭菌周期结束后,取经过一个灭菌周期处理过的试验器材(内径为1mm的聚四氟乙烯管腔2m、内径为1mm的不锈钢管腔500mm),分别用100mL纯化水浸泡1min,制成待检样品。按照GB 19192-2003中5.1.5的方法进行测试,每个样品测定2次,取平均值,判断是否符合4.1.4.3。
8.2 过氧化氢检验
判断过氧化氢灭菌剂及制造商提供的资料,是否符合4.2.1、4.2.2。
8.3 显示装置检验
运行灭菌器,判断是否符合4.3。
8.4 记录与输出装置检验
运行灭菌器,判断是否符合4.4。
8.5 灭菌效果及监测检验
按照附录A或附录B进行测试,判断是否符合4.5。
8.6 安全性检验
8.6.1 过氧化氢环境暴露
8.6.1.1 检查灭菌器和使用说明书,判断是否符合4.6.1.1。
8.6.1.2 在制造商说明书规定的使用环境下,按照GBZ/T 300.48的方法进行测试,将测试结果按照GBZ 159中的要求进行计算,判断是否符合4.6.1.2。
8.6.2 生物相容性检验
按照附录C制备样品。金属及非金属材质灭菌物品经过氧化氢气体等离子体低温灭菌后4h内测试,按照GB/T 16886.5进行细胞毒性试验,结果应为阴性;如细胞毒性试验为阳性,则按照GB/T 16886.10刺激与延迟式超灵敏性试验方法进行皮下注射反应试验及按照GB/T 16886.11全身毒性试验方法进行皮下静脉注射反应试验,结果均为阴性则与人体生物相容。
8.6.3 材料相容性检验
按照附录D制备金属及非金属材质样品,样品按照《消毒技术规范》(2002年版)中2.2.4的规定评价金属腐蚀性;非金属材质腐蚀性由制造商负责评价。判断是否符合4.6.3。
9 标志与包装
9.1 标志
所使用的标志及标签应符合GB/T 191的要求。
9.2 包装
包装标识应符合消毒产品标签说明书有关规范和标准的要求。
10 运输和贮存
10.1 运输
运输用一般交通工具或按合同要求运输,并有防雨、防潮、防冲击和剧烈振动措施。
10.2 贮存
包装后贮存在温度≥0℃,相对湿度≤93%,无腐蚀物体和通风良好的室内。
附录A(规范性附录) 灭菌效果检测方法
A.1 方法原理
本试验以常见的硬式镜不锈钢材料管腔、软式镜聚四氟乙烯材料管腔为模拟管腔,验证微生物的灭菌效果。本试验应采用两端开口的无缝测试管腔,如有接缝,则应保证气密性。在管腔中央放置染有细菌芽孢的载体,通过半周期灭菌循环,无菌生长。以嗜热脂肪杆菌芽孢为指标菌,同时进行微生物灭菌效果评价,所有试验均为阴性培养结果,则判定结果合格。
A.2 生物指示物
嗜热脂肪杆菌芽孢(ATCC7953)。
A.3 验证器材
A.3.1 载体:将芽孢液均匀涂布在直径为0.4mm、长度为20mm~30mm不锈钢检测材质上,以染菌后不堵塞管腔为限。嗜热脂肪杆菌芽孢阳性回收菌量应为1×106CFU/载体~5×106CFU/载体,室温下自然干燥后再使用。
A.3.2 检测管腔:本试验宜采用两端开口的无缝测试管腔,如有接缝,则应保证气密性。
A.3.3 不锈钢材质无接缝管腔,10根。
A.3.4 聚四氟乙烯无接缝管腔,10根。
A.3.5 嗜热脂肪杆菌芽孢的TSB培养基:干粉胰蛋白胨17.0g,植物蛋白胨3.0g,氯化钠5.0g,磷酸氢二钾2.5g,葡萄糖2.5g,共30g溶于1L蒸馏水中,制成胰蛋白胨大豆肉汤(TSB)培养基。
A.4 操作步骤
A.4.1 将染菌的载体送达不锈钢管腔的正中央,制作10根测试样本。将10根测试样本均匀平行摆放在器械盒内,用双层无纺布包裹,放置在灭菌舱内,灭菌舱内如仅一层隔架,则10根样本平行摆放在器械盒内放置在灭菌舱中央(见图A.1);若灭菌舱内可摆放上下两层隔架,则将10根样本均匀摆放在两个器械盒内,分别放置在灭菌舱内上下两层隔架中央(见图A.2)。
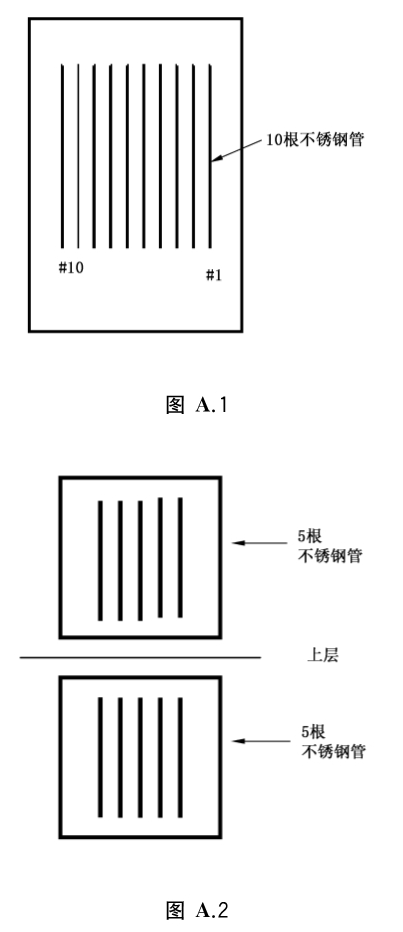
按照《消毒技术规范》(2002版)中的灭菌操作步骤进行半周期灭菌,灭菌结束后以无菌操作取出细菌芽孢载体,均放到TSB培养基中,56℃培养48h,观察培养结果,如无细菌生长则继续培养至7d,培养结果仍无细菌生长则判断为阴性。
A.4.2 将染菌的体用细丝送达聚四氟乙烯管腔的正中间,制作10根测试样本。将10根测试样本均匀平行摆放在器械盒内,用双层无纺布包裹,放置在灭菌舱内,灭菌舱内如仅一层隔架,则10根样本平行摆放在器械盒内放置在灭菌舱中央(见图A.3);若灭菌舱内可摆放上下两层隔架,则将10根样本均匀摆放在两个器械盒内,分别放置在灭菌舱内上下两层隔架中央(见图A.4)。
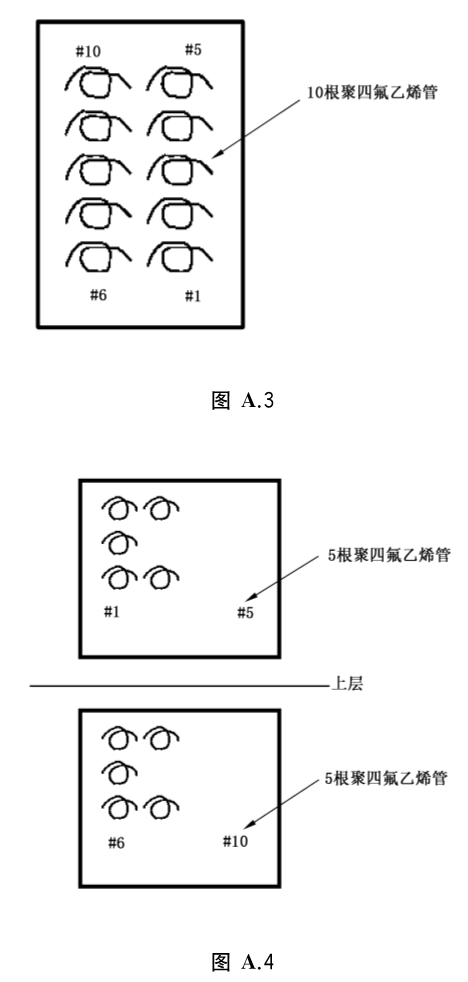
按照《消毒技术规范》(2002年版)中的灭菌操作步骤进行半周期灭菌,灭菌结束后取出细菌芽孢载体,全部放到TSB培养基中,56℃培养48h,观察培养结果如无细菌生长则继续培养至7d,培养结果仍无细菌生长则判定阴性。
A.5 结果计算
嗜热脂肪杆菌芽孢重复以上两种材质的模拟管腔,微生物测试各重复5次。
A.6 结果判定
测试结果均无细菌生长,为阴性,则判定无菌合格。
附录B(规范性附录) 过氧化氢气体等离子体低温灭菌的生物监测方法
B.1 嗜热脂肪杆菌芽孢生物指示物
载体应对过氧化氢无吸附作用,每一载体上的菌量应达到1×106CFU,所用芽孢对过氧化氢气体的抗力应稳定并鉴定合格,所用产品应符合国家相关管理要求的管腔生物监测包或非管腔生物监测包对灭菌器的灭菌质量进行生物监测。
B.2 管腔生物监测包的监测方法
灭菌管腔器械时,使用管腔生物PCD或使用等同于管腔生物PCD的验证装置进行监测。该装置应该被证明其是与管腔PCD具有同等的甚至更强抗力的灭菌挑战装置。应将管腔生物监测包放置于灭菌器内最难灭菌的部位(按照制造商说明书建议,远离过氧化氢注入口,如灭菌舱下层器械搁架的后方)满载进行灭菌。灭菌周期完成后立即将管腔生物PCD从灭菌器中取出,56℃±2℃培养7d(或按产品说明书执行),观察培养结果。
B.3 非管腔生物监测包的监测方法
灭菌非管腔器械时,应使用非管腔生物监测包进行监测,应将自含式生物指示物,置于特卫强包装袋内,密封式包装后,放置于灭菌器内最难灭菌的部位(按照制造商说明书建议,远离过氧化氢注入口,如灭菌舱下层器械搁架的后方)。灭菌周期完成后立即将非管腔生物监测包从灭菌器中取出,按自含式生物指示物说明书进行培养,观察培养结果。
B.4 结果判定
阳性对照组培养阳性,阴性对照组培养阴性,实验组培养阴性,判定为灭菌合格。阳性对照组培养阳性,阴性对照组培养阴性,实验组培养阳性,判定为灭菌失败;同时应进一步鉴定实验组阳性的细菌是否为指示菌或是污染所致。
附录C(规范性附录) 检测样品的制备方法
C.1 取器说明书中所列的金属和非金属器械材质为检验材质,每种材质制作成60cm2(100mm×60mm)大小样本3个。材质应为医用级。
C.2 用中性仪器洗涤液漂洗每个样品,然后用蒸馏水彻底漂清,去除表面污染物和残留清洁剂。
C.3 用无纺棉布揩干每个材料。用洁净过滤空气(或等效物)吹干,除去样品上残留的纤维。
C.4 将干燥清洁的样品放在干净的实验环境中,防止与化学药品和过氧化氢蒸气接触。
C.5 用单层Tyvek包装袋分别包每一材料样品,防止细菌进入,同时保证过氧化氢的渗入。
C.6 将检验样品平放放入灭菌设备械盒内,不加盖器械盒盖,将器械盒放置在灭菌舱上层中央。
C.7 按照制造商的操作说明将灭菌舱温度设定在最低允许极限,注入最大剂量过氧化氢灭菌剂。
C.8 进行全周期灭菌。
附录D(规范性附录) 材质相容性检测
D.1 方法原理
器械经过多次过氧化氢气体等离子体低温灭菌后,器械表面无腐蚀。测定灭菌后器械材质的相容性,可以判定灭菌过程中过氧化氢对器械的相容性。
D.2 样品制备及操作步骤
D.2.1 参考《消毒技术规范》(2002年版)中3.4.2制备样本。
金属片样本:圆形,直径24.00mm,厚1.00mm,穿一直径为2.00mm小孔,表面积总值约为9.80cm2(包括上、下、周边表面与小孔侧面)。光洁度为6。原料如下:
碳钢(规格见GB/T 700)
铜(规格见GB/T 2059)
铝(规格见GB/T 1173)
不锈钢(规格见GB/T 1220)
用中性仪器洗涤液漂洗每个样品,然后用蒸馏水彻底漂清,去除表面污染物和残留清洁剂。用无纺棉布揩干每个材料。用洁净过滤空气(或等效物)吹干,除去样品上残留的纤维。样品称重,每片样品待天平回零后称重3次,精确至0.1mg,取其平均值作为试验前重量(称重时,应戴洁净手套,勿以手直接接触样片)。用单层Tyvek包装袋分别包裹每种材质的检验样品,防止细菌进入,同时保证过氧化氢的渗入。
D.2.2 将检验样品平放放入灭菌设备器械盒内,不加器械盒盖,将器械盒放置在灭菌舱上层中央。按照制造商的操作说明将灭菌舱温度设定在最低允许极限,注入最大剂量过氧化氢灭菌剂进行全周期灭菌。
D.2.3 器械无腐蚀验证灭菌的循环次数:不小于100次。
D.3 检测
灭菌结束后,将装载样品取出,按照《消毒技术规范》(2002版)进行金属腐蚀性评价。
D.4 结果判定
参考《消毒技术规范》(2002年版)中3.4.3(9)进行结果判定。观察金属的颜色变化,金属表面的腐蚀速率R<0.01,基本无腐蚀。非金属表面的腐蚀结果按制造商的标准进行判定。
免责申明:本站所有资源均通过网络等公开合法渠道获取,该资料仅作为阅读交流使用,并无任何商业目的,其版权归作者或出版方所有,本站不对所涉及的版权问题负任何法律责任和任何赔偿,在本站咨询或购买后默认同意此免责申明;
法律责任:如版权方、出版方认为本站侵权,请立即通知本站删除,物品所标示的价格,是对本站搜集、整理、加工该资料以及本站所运营的费用支付的适当补偿,资料索取者(顾客)需尊重版权方的知识产权,切勿用于商业用途,信息;

『JB T2728.4-2008』电机用气体冷却器 第4部分:绕片式气体冷却器技术要求
...
2025-05-18

『GBZ1-2010』工业企业设计卫生标准
中国人民共和国国家职业卫生标准工业企业设计卫生标准HygienicstandardsforthedesignofindustrialenterprisesGBZ1-2010发布部门:中华人民共和国卫生部发布日期:201...
2025-05-11

『JGJ T263-2012』住宅卫生间模数协调标准
中华人民共和国行业标准住宅卫生间模数协调标准StandardformodulecoordinationofresidentialbathroomJGJ/T263—2012批准部门:中华人民共和国住房和城乡建设部施行...
2025-05-07

『GB50869-2013』生活垃圾卫生填埋处理技术规范
中华人民共和国国家标准生活垃圾卫生填埋处理技术规范TechnicalcodeformunicipalsolidwastesanitarylandfillGB50869-2013主编部门:中华人民共和国住房和城乡建设...
2025-05-05

『GB T13477.7-2002』建筑密封材料试验方法 第7部分:低温柔性的测定
...
2025-04-30

长春市市容和环境卫生管理条例
长春市市容和环境卫生管理条例长春市市容和环境卫生管理条例(2003年10月23日长春市第十二届人民代表大会常务委员会第七次会议审议通过2003年11月29日吉林省第十届...
2025-04-18